- Водородный показатель (pH-фактор)
- Методы определения значения pH
- Показатели острого порядка
- Универсальный индекс.
- PH-метры.
- Аналитический метод определения емкости
- Влияние температуры на значения pH
- Подкисление питательных растворов
- Подщелачивание питательных растворов
- Шкала pH
- Методы определения величины pH
- Использование индикаторов
- Ионометрический метод
- Аналитический объемный метод
- Влияние температуры на значение pH
- Определение pH воды
- Зачем измеряется pH воды?
- Основные способы определения
- Лакмусовая бумажка
Нормальная кислотность спермы находится в диапазоне 7,2-8,0 pH. Отклонения от этих значений не считаются патологией. Однако в сочетании с другими отклонениями они могут указывать на наличие заболевания.
Водородный показатель (pH-фактор)
pH является мерой активности ионов водорода в растворе и количественно определяет его кислотность. Если pH не оптимален, растение начинает терять способность поглощать некоторые элементы, необходимые для здорового роста. Каждое растение имеет определенное значение pH, при котором оно может получить максимальную пользу от выращивания. Большинство растений предпочитают слегка кислую среду для выращивания (в пределах 5,5-6,5).
В очень разреженных растворах pH соответствует концентрации ионов водорода. Он равен упругому объему и противоположен знаку, содержащему десятичный логарифм активности ионов водорода, выраженной в Моль на литр.
В нормальных условиях значения pH варьируются от 0 до 14. В чистой воде при нейтральном pH концентрация H+ равна концентрации OH, которая составляет от 1-10 до 7 моль на литр. Максимальное значение pH, определяемое как сумма pH и POH, равно 14.
Вопреки распространенному мнению, pH может варьироваться от 0 до 14, а также выше. Например, если концентрация водородных ионов H+ = 10 -15 моль/л и pH = 15, то концентрация гидроксид-ионов составляет OH = 10 моль/л и POH = -1.
ВАЖНО! Шкала pH является логарифмической. Это означает, что каждая единица изменения равна 10-кратному увеличению концентрации ионов водорода. Другими словами, раствор pH 6 в 10 раз более кислый, чем раствор pH 7, раствор pH 5 в 10 раз более кислый, чем раствор pH 6, и в 100 раз более кислый, чем раствор pH 7. Регулировка pH питательных растворов требует изменения pH на две единицы (с 7,5 до 5,5) (с 7,5 на 6,5) следует использовать в 10 раз больше скорректированного pH, чем при регулировке только одной единицы.
Методы определения значения pH
Для определения значения pH раствора обычно используются различные методы. К уровню pH можно приблизиться с помощью индикатора, точно измерить его с помощью счетчика pH или детализировать с помощью секьюрити на основе кислоты.
Показатели острого порядка
Принятие острого веса — органические красители, цвет которых зависит от рН среды, широко используются для приблизительного определения концентрации водородных ионов. Наиболее известными являются лахмос, фенол-окуляр и метил-покаль (метиловая дверь). Индикаторы могут существовать в виде двух разных цветов, кислотного или основного. Каждый индекс меняет цвет в определенном диапазоне pH, обычно между 1 и 2.
Универсальный индекс.

Для расширения диапазона измерения рН используется универсальный показатель SO -Caled, который представляет собой смесь различных индикаторов. Универсальный индекс меняет цвет с красного на желтый, зеленый, синий или фиолетовый при переходе из области кислоты в область основания.
Растворы таких смесей («универсальные индикаторы») обычно пропитываются «индикаторными» полосками, которые позволяют быстро измерить кислотность исследуемого водного раствора (с точностью до pH или десятков). Для более точных измерений цвет индикаторной полоски, полученной из капли раствора, сразу же сравнивают с эталонной шкалой, показанной на диаграмме.
Измерение pH индикаторным методом затруднено при использовании мутных или окрашенных растворов.
Поскольку оптимальное значение pH для гидропонных питательных растворов очень узкое (обычно между 5,5 и 6,5), используются другие комбинации индикаторов. Например, рабочий диапазон жидких тестов на pH составляет от 4,0 до 8,0, поэтому такие тесты более точны, чем универсальные индикаторы.

PH-метры.

pH-метр, специальный прибор, может использоваться для измерения pH в более широком диапазоне и с большей точностью (до 0,01 единицы pH), чем универсальный индикатор. Этот метод удобен и очень точен, особенно после калибровки индикаторного электрода в выбранном диапазоне pH. Он широко используется, поскольку может измерять pH непрозрачных и окрашенных растворов.
Для более детального изучения темы рекомендуем обратиться к соответствующему разделу «pH-метры» на форуме.
Аналитический метод определения емкости
Метод аналитической емкости (кислотно-основное титрование) также дает точные результаты для определения кислотности раствора. Раствор известной концентрации (титрант) опускают в испытуемый раствор. При смешивании происходит химическая реакция. Точка равновесия, точка, в которой потенции достаточно для завершения реакции, регистрируется с помощью указателя. Затем известны концентрация и объем добавленного титранта и рассчитывается кислотность раствора.
Влияние температуры на значения pH
Значение pH может изменяться в широком диапазоне при изменении температуры. Например, 0,001 молярный раствор NaOH при 20°C имеет pH = 11,73, а при 30°C pH = 10,83. Влияние температуры на значения pH обусловлено различиями в разложении ионов водорода (H+) и не является экспериментальной ошибкой. Влияние температуры не может быть нивелировано электроникой pH-метра.
Подкисление питательных растворов
Питательные растворы обычно нуждаются в подкислении. По мере того как растения поглощают ионы, раствор постепенно становится более щелочным. Растворы с pH выше 7 обычно возвращаются к своему оптимальному pH. Для подкисления питательных растворов можно использовать различные кислоты. Обычно используется серная или фосфорная кислота. Лучшими решениями для гидропоники являются буферные растворы, такие как pH минус цветение или pH минус рост. Эти продукты не только регулируют pH до оптимальной цены, но и стабилизируют цену в долгосрочной перспективе.
При регулировке значений pH с помощью кислот и щелочей следует надевать эластичные перчатки во избежание ожогов кожи. Опытный химик имеет опыт работы с концентрированной серной кислотой. Он добавляет кислоту в воду капля за каплей. Однако в начинающей гидропонике, вероятно, лучше попросить опытного химика приготовить 25%-ный раствор серной кислоты. Добавляя кислоту, перемешайте раствор и измерьте его pH. После того как известно приблизительное количество серной кислоты, ее можно добавить из мерного цилиндра.
Серную кислоту следует добавлять в небольших количествах, чтобы избежать окисления раствора. Этот показатель должен быть увеличен еще раз. Для бесконечных рабочих подкисление и ощелачивание может продолжаться бесконечно долго. Помимо потери времени и реагентов, при таком способе регулировки питательный раствор выводится из равновесия, что накапливает нежелательные ионы в растении.
Подщелачивание питательных растворов
Очень кислые растворы можно подщелачивать каустической содой (гидроксидом натрия). Его название говорит о том, что он едкий, поэтому следует надевать резиновые перчатки. Рекомендуется приобретать гидроксид натрия в форме таблеток. Гидроксид натрия можно приобрести в бытовых чистящих средствах. Моляр. Растворите таблетки в 0,5 л воды и постепенно добавьте щелочной раствор в питательный раствор при постепенном перемешивании и агитации, часто контролируя значение pH. Невозможно рассчитать, сколько кислоты или щелочи нужно добавить в каждом конкретном случае.
Если вы хотите выращивать различные культуры в одном поддоне, необходимо подобрать не только оптимальный уровень pH, но и удовлетворить требования других факторов роста. Например, желтый нарцисс и хризантема требуют pH 6,8, но их нельзя выращивать на одном поддоне, так как они требуют разного режима влажности. Если нарцисс получит столько же влаги, сколько и хризантема, луковица нарцисса сгниет. В экспериментах ревень достигал максимального роста при pH 6,5, но даже при pH 3,5 он рос. OATS, которые предпочитают pH около 6, также дают хорошие урожаи при pH 4, если значительно увеличить содержание питательных веществ в азоте. Картофель растет в довольно широком диапазоне pH, но лучше всего растет при pH 5,5. При таком pH также достигаются высокие клубни, но с кислым вкусом. Для получения максимального урожая высокого качества необходимо точно отрегулировать pH питательного раствора.
Он отражает степень кислотности или щелочности среды, а не количественное химическое содержание воды. В разреженных растворах мера активности эквивалентна концентрации, поэтому при определенных условиях один член заменяет другой.
Шкала pH
На основе стабильности значений ионного произведения воды построена шкала значений рН для различных растворов. Цифра «7» в нем соответствует числу слева от 7 в нейтральных и кислотных средах и справа в основных (щелочных) средах.
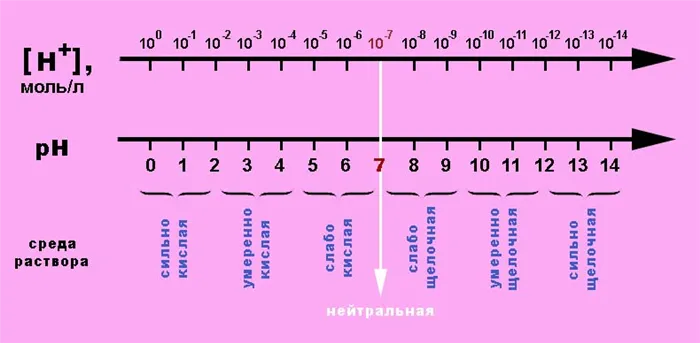
Важно помнить, что снижение pH означает увеличение концентрации, т.е. кислотные свойства, и наоборот, поскольку для снятия «негатива» показателя кислотности используются отрицательные логарифмы. Таким образом, значение 5 соответствует концентрации = моль⁄л и кислотности выше 9. Это означает, что в растворе содержится моль⁄л водорода.
Методы определения величины pH
В зависимости от цели и условий, значение водородного показателя может быть определено различными методами. Качественная оценка кислотности среды может быть выполнена с помощью индикатора. Точные количественные результаты могут быть получены с помощью метода измерения.
Использование индикаторов
Этот метод основан на способности некоторых органических веществ изменять цвет в зависимости от кислотности среды. Обычными показателями являются показатели лаккозы, метиранги и фенолового глаза. Каждый из них проявляет свои свойства в ограниченном диапазоне значений рН.
Индексные методы легко воспринимаются и быстры, но недостаточно точны и зависят от субъективного восприятия цвета.
Универсальный индекс повышает точность. Она представляет собой смесь веществ и охватывает широкий диапазон pH от 0 до 14. Цвет, полученный индикатором на листе бумаги в определенной среде, сравнивается с эталонной шкалой. Общий индикатор позволяет определить pH с точностью до десятых долей градуса.

Маркерный метод неэффективен, если раствор слишком слабый, имеет собственный темный цвет или мутный.
Ионометрический метод
Концентрацию водорода можно определить с точностью до 0,01 в широком диапазоне с помощью pH-метра. Прибор представляет собой электронный миллиамперметр, определяющий разность потенциалов на электродах, один из которых (pH-электрод) помещается в исследуемый раствор. Другой электрод сравнения погружается в раствор электролита с заданным pH. На этом электроде создается постоянный потенциал, относительно которого измеряется pH тестируемой среды. Разность потенциалов пропорциональна значению pH.
pH-метр требует тщательной калибровки. Для этого используется специально приготовленный буфер с эталонным значением pH. Он стабилен при разбавлении или при добавлении небольшого количества сильных кислот или оснований. Для приготовления буферов для измерения стандартных титров pH используется набор чистых реагентов точно известной массы. Его разбавляют до необходимой концентрации дистиллированной водой.
Современные pH-метры намного проще в использовании, так как они имеют комбинированные электроды вместо двух.
Аналитический объемный метод
Этот метод определения значений pH использует процедуру кислотно-основного титрования. В этой процедуре основную роль играет реакция нейтрализации между исследуемым образцом и титрантом (стандартным раствором с определенным значением pH). При титровании кислых растворов в качестве титранта используется щелочь (гидроксид натрия или гидроксид калия); для оснований титрантом служит раствор сильной кислоты (гидрохлорид или сульфат).
Титрант медленно добавляют к образцу до изометрической точки, в которой титруемый раствор полностью нейтрализован. Конечная точка титрования может быть определена несколькими методами: по индексу, потенциометрией, спектрофотометрией или измерением проводимости. Определив количество титранта, необходимое для нейтрализации, и зная его концентрацию, можно рассчитать pH препарата.
Влияние температуры на значение pH
При повышении температуры разложение слабых электролитов, включая воду, увеличивается. Концентрация ионного равновесия увеличивается, а ионные продукты возрастают. Водородный показатель нейтральной среды изменяется соответственно: водородный показатель нейтральной среды изменяется.
Изменения температуры оказывают сложное и неоднозначное влияние на измерения pH. В целом, органические и щелочные образцы более зависимы от них, чем неорганические и кислотные. При измерениях pH и титровании температура строго контролируется, а полученные результаты пересчитываются с характерными значениями при 25°C.
Установите pH-метр в калибровочный раствор. Подождите. На задней стороне psmeter имеется винт, который необходимо повернуть по часовой стрелке или против часовой стрелки в зависимости от значения на дисплее. Значение на экране должно соответствовать pH раствора! Вот и весь процесс!
Определение pH воды

Качество питьевой воды напрямую зависит от значения pH. Это одна из самых важных особенностей решения. В зависимости от цены параметра определяется тип химического процесса, проводимого с жидкостью, пригодность воды к употреблению и возможность ее использования в быту или народном хозяйстве.

Зачем измеряется pH воды?
Аббревиатура pH переводится как водород. Дословный перевод этой фразы — «водородный вес». Поэтому, чтобы определить качество воды, необходимо рассчитать количество содержащихся в ней ионов водорода. Для нейтральных растворов их количество равно количеству гидроксильных ионов. Поэтому значение pH выше 7 говорит о том, что раствор является необходимым. Если параметр сдвигается к нулю, вода определяется как кислота. Нейтральная жидкость имеет pH = 7.
Этот параметр следует регулярно контролировать, так как резкое изменение кислотности указывает на инфекцию или ухудшение свойств синтеза воды. Для питьевой воды особенно важно обращать внимание на значение pH.
Параметры также имеют техническое значение. Кислотность определяет чувствительность воды к загрязнению и поэтому используется для выбора материалов против коррозии. Важно, чтобы все жидкости, поступающие по трубопроводам в дома и на промышленные предприятия, находились в определенном диапазоне. Если значение pH ниже 7, это может привести к образованию ржавчины на поверхности трубы и ее быстрому износу.
Высокая кислотность также может привести к образованию в трубе различного количества осадков, образующих засоры.

Основные способы определения
pH раствора можно измерить с помощью различных методов. Эксперты используют различные индикаторы, тест-полоски и LAM. Последний вариант считается наиболее распространенным из-за своей простоты и низкой стоимости. Для определения кислотности также используются электромеханические методы. Самые популярные режимы тестирования стоит рассмотреть подробнее.
Лакмусовая бумажка
Самый доступный вариант для измерения pH в бутылках, аквариумах и других емкостях. Он подходит для домашнего использования и считается удобным средством измерения кислотности раствора. В этом случае патентованный краситель выступает в качестве кислотного индикатора, с помощью которого можно определить значение рН и свойства жидкости.
Камень — это растительный краситель, который меняет свой цвет на синий при щелочности и красный при кислотности. Для проверки кислотности бумагу опускают в пробирку с водой. Когда бумага взаимодействует с раствором, она меняет цвет. Существует два возможных способа сделать это
- Бумага окрашивается в синий цвет. Показатель pH>7.
- Бумага приобретает красный оттенок. Показатель pH